Цинк (химич. элемент)
Цинк (химич. элемент)
Цинк (лат. Zincum), Zn, химический элемент II группы периодической системы Менделеева; атомный номер 30, атомная масса 65,38, синевато-белый металл. Известно 5 стабильных изотопов с массовыми числами 64, 66, 67, 68 и 70; наиболее распространён 64 Zn (48,89%). Искусственно получены 9 радиоактивных изотопов, среди которых наиболее долгоживущий 65 Zn с периодом полураспада T1 /2 = 245 сут; применяется как изотопный индикатор .
Историческая справка. Сплав Ц. с медью — латунь — был известен ещё древним грекам и египтянам. Чистый Ц. долгое время не удавалось выделить. В 1746 А. С. Маргграф разработал способ получения металла прокаливанием смеси его окиси с углём без доступа воздуха в глиняных огнеупорных ретортах с последующей конденсацией паров Ц. в холодильниках. В промышленном масштабе выплавка Ц. началась в 17 в.
Распространение в природе. Среднее содержание Ц. в земной коре (кларк) — 8,3?10-3 % по массе, в основных изверженных породах его несколько больше (1,3?10-2 %), чем в кислых (6?10-3 %). Известно 66 минералов Ц., важнейшие из них — цинкит , сфалерит , виллемит , каламин , смитсонит , франклинит ZnFe2 O4 . Ц. — энергичный водный мигрант; особенно характерна его миграция в термальных водах вместе с Pb; из этих вод осаждаются сульфиды Ц., имеющие важное промышленное значение (см. Полиметаллические руды ). Ц. также энергично мигрирует в поверхностных и подземных водах; главным осадителем для него является H2 S, меньшую роль играет сорбция глинами и др. процессы. Ц. — важный биогенный элемент; в живом веществе содержится в среднем 5?10-4 % Ц., но имеются и организмы-концентраторы (например, некоторые фиалки).
Физические и химические свойства. Ц. — металл средней твёрдости. В холодном состоянии хрупок, а при 100—150 °С весьма пластичен и легко прокатывается в листы и фольгу толщиной около сотых долей миллиметра. При 250 °С вновь становится хрупким. Полиморфных модификаций не имеет. Кристаллизуется в гексагональной решётке с параметрами а
= 2,6594
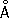 , с
= 4,9370
, с
= 4,9370
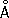 . Атомный радиус 1,37
. Атомный радиус 1,37
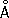 ; ионный Zn2+
— 0,83
; ионный Zn2+
— 0,83
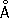 . Плотность твёрдого Ц. 7,133 г/см3
(20 °С), жидкого 6,66 г/см3
(419,5 °С); tпл
419,5 °С; tкип
906 °С. Температурный коэффициент линейного расширения 39,7?10-6
(20—250 °С), коэффициент теплопроводности 110,950 вт/
(м
?К
) 0,265 кал/см
?сек
?°С (20 °С), удельное электросопротивление 5,9?10-6
ом
?см
(20 °С), удельная теплоёмкость Ц. 25,433 кдж/
(кг
?К) [6,07 кал/г
?о
С
)].
Предел прочности при растяжении 200—250 Мн/м2
(2000—2500 кгс/см2
),
относительное удлинение 40—50%, твёрдость по Бринеллю 400—500 Мн/м2
(4000—5000 кгс/см2
). Ц. диамагнитен, его удельная магнитная восприимчивость — 0,175?10-6
.
. Плотность твёрдого Ц. 7,133 г/см3
(20 °С), жидкого 6,66 г/см3
(419,5 °С); tпл
419,5 °С; tкип
906 °С. Температурный коэффициент линейного расширения 39,7?10-6
(20—250 °С), коэффициент теплопроводности 110,950 вт/
(м
?К
) 0,265 кал/см
?сек
?°С (20 °С), удельное электросопротивление 5,9?10-6
ом
?см
(20 °С), удельная теплоёмкость Ц. 25,433 кдж/
(кг
?К) [6,07 кал/г
?о
С
)].
Предел прочности при растяжении 200—250 Мн/м2
(2000—2500 кгс/см2
),
относительное удлинение 40—50%, твёрдость по Бринеллю 400—500 Мн/м2
(4000—5000 кгс/см2
). Ц. диамагнитен, его удельная магнитная восприимчивость — 0,175?10-6
.
Внешняя электронная конфигурация атома Zn 3d10 4s2 . Степень окисления в соединениях +2. Нормальный окислительно-восстановительный потенциал, равный 0,76 в, характеризует Ц. как активный металл и энергичный восстановитель. На воздухе при температуре до 100 °С Ц. быстро тускнеет, покрываясь поверхностной плёнкой основных карбонатов. Во влажном воздухе, особенно в присутствии СО2 , происходит разрушение металла даже при обычных температурах. При сильном нагревании на воздухе или в кислороде Ц. интенсивно сгорает голубоватым пламенем с образованием белого дыма цинка окиси ZnO. Сухие фтор, хлор и бром не взаимодействуют с Ц. на холоду, но в присутствии паров воды металл может воспламениться, образуя, например, ZnCl2 . Нагретая смесь порошка Ц. с серой даёт сульфид Ц. ZnS. Сульфид Ц. выпадает в осадок при действии сероводорода на слабокислые или аммиачные водные растворы солей Zn. Гидрид ZnH2 получается при взаимодействии LiAIH4 с Zn (CH3 )2 и др. соединениями Ц.; металлоподобное вещество, разлагающееся при нагревании на элементы. Нитрид Zn3 N2 — чёрный порошок, образуется при нагревании до 600 °С в токе аммиака; на воз духе устойчив до 750 °С, вода его разлагает. Карбид Ц. ZnC2 получен при нагревании Ц. в токе ацетилена. Сильные минеральные кислоты энергично растворяют Ц., особенно при нагревании, с образованием соответствующих солей. При взаимодействии с разбавленными HCl и H2 SO4 выделяется H2 , а с HNO3 — кроме того, NO, NO2 , NH3 . С концентрированными HCl, H2 SO4 и HNO3 Ц. реагирует, выделяя соответственно H2 , SO2 , NO и NO2 . Растворы и расплавы щелочей окисляют Ц. с выделением На и образованием растворимых в воде цинкатов . Интенсивность действия кислот и щелочей на Ц. зависит от наличия в нём примесей. Чистый Ц. менее реакционноспособен по отношению к этим реагентам из-за высокого перенапряжения на нём водорода. В воде соли Ц. при нагревании гидролизуются, выделяя белый осадок гидроокиси Zn (OH)2 (см. Амфотерность ). Известны комплексные соединения , содержащие Ц., например [Zn (NH3 )4 ] SO4 и др.
Получение. Ц. добывают из полиметаллических руд, содержащих 1—4% Zn в виде сульфида, а также Cu, Pb, Ag, Au, Cd, Bi. Руды обогащают селективной флотацией, получая цинковые концентраты (50—60% Zn) и одновременно свинцовые, медные, а иногда также пиритные концентраты. Цинковые концентраты обжигают в печах в кипящем слое , переводя сульфид Ц. в окись ZnO; образующийся при этом сернистый газ SO2 расходуется на производство серной кислоты . От ZnO к Zn идут двумя путями. По пирометаллургическому (дистилляционному) способу, существующему издавна, обожжённый концентрат подвергают спеканию для придания зернистости и газопроницаемости, а затем восстанавливают углём или коксом при 1200—1300 °С: ZnO + С = Zn + CO. Образующиеся при этом пары металла конденсируют и разливают в изложницы. Сначала восстановление проводили только в ретортах из обожжённой глины, обслуживаемых вручную, позднее стали применять вертикальные механизированные реторты из карборунда (см. Огнеупоры ), затем — шахтные и дуговые электропечи; из свинцово-цинковых концентратов Ц. получают в шахтных печах с дутьём. Производительность постепенно повышалась, но Ц. содержал до 3% примесей, в том числе ценный кадмий. Дистилляционный Ц. очищают ликвацией (т. е. отстаиванием жидкого металла от железа и части свинца при 500 °С), достигая чистоты 98,7%. Применяющаяся иногда более сложная и дорогая очистка ректификацией даёт металл чистотой 99,995% и позволяет извлекать кадмий.
Основной способ получения Ц. — электролитический (гидрометаллургический). Обожжённые концентраты обрабатывают серной кислотой; получаемый сульфатный раствор очищают от примесей (осаждением их цинковой пылью) и подвергают электролизу в ваннах, плотно выложенных внутри свинцом или винипластом. Ц. осаждается на алюминиевых катодах, с которых его ежесуточно удаляют (сдирают) и плавят в индукционных печах. Обычно чистота электролитного Ц. 99,95%, полнота извлечения его из концентрата (при учёте переработки отходов) 93—94%. Из отходов производства получают цинковый купорос, Pb, Cu, Cd, Au, Ag; иногда также In, Ga, Ge, Tl.
Применение. Около половины производимого Ц. расходуется на защиту стали от коррозии (см. Цинкование ).
Поскольку Ц. в ряду напряжений стоит до железа, то при попадании оцинкованного железа в коррозионную среду разрушению подвергается Ц. Благодаря хорошим литейным качествам и низкой температуре плавления из Ц. отливают под давлением различные мелкие детали самолётов и др. машин. Сплавы меди с Ц. — латунь , нейзильбер , а также Ц. со свинцом и др. металлами широко применяются в технике (см. Цинковые сплавы ). Ц. даёт с золотом и серебром интерметаллиды (нерастворимые в жидком свинце) и поэтому Ц. применяется для рафинирования свинца от благородных металлов. В виде порошка Ц. служит восстановителем в ряде химико-технологических процессов: в производстве гидросульфита, при осаждении золота из промышленных цианистых растворов, меди и кадмия при очистке растворов цинкового купороса и др. Многие соединения Ц. являются люминофорами , например три основных цвета на экране кинескопа зависят от ZnS?Ag (синий цвет), ZnSe?Ag (зелёный цвет) и Zn3 (PO4 )2 ?Mn (красный цвет). Важными полупроводниковыми материалами служат соединения Ц. типа AII BVI — ZnS, ZnSe, ZnTe, ZnO. Магнитно-мягкими ферритами отечественных марок МН и HH являются соответственно марганец- и никель-цинковые шпинели.
Наиболее распространённые химические источники тока (например, Лекланше элемент , окиснортутный элемент ) имеют в качестве отрицательного электрода Ц.
Н. Н. Севрюков.
Ц. в организме. Ц. как один из биогенных элементов постоянно присутствует в тканях растений и животных. Среднее содержание Ц. в большинстве наземных и морских организмов — тысячные доли процента. Богаты Ц. грибы, особенно ядовитые, лишайники, хвойные растения и некоторые беспозвоночные морские животные, например устрицы (0,4% сухой массы). В зонах повышенных содержаний Ц. в горных породах встречаются концентрирующие Ц. т. н. галмейные растения . В организм растений Ц. поступает из почвы и воды, животных — с пищей. Суточная потребность человека в Ц. (5—20 мг ) покрывается за счёт хлебопродуктов, мяса, молока, овощей; у грудных детей потребность в Ц. (4—6 мг ) удовлетворяется за счёт грудного молока.
Биологическая роль Ц. связана с его участием в ферментативных реакциях, протекающих в клетках. Он входит в состав важнейших ферментов: карбоангидразы, различных дегидрогеназ, фосфатаз, связанных с дыханием и др. физиологическими процессами, протеиназ и пептидаз, участвующих в белковом обмене, ферментов нуклеинового обмена (РНК- и ДНК-полимераз) и др. Ц. играет существенную роль в синтезе молекул информационной РНК на соответствующих участках ДНК (транскрипция), в стабилизации рибосом и биополимеров (РНК, ДНК, некоторые белки).
В растениях наряду с участием в дыхании, белковом и нуклеиновом обменах Ц. регулирует рост, влияет на образование аминокислоты триптофана. повышает содержание гиббереллинов. Ц. стабилизирует макромолекулы различных биологических мембран и может быть их интегральной частью, влияет на транспорт ионов, участвует в надмолекулярной организации клеточных органелл. В присутствии Ц. в культуре Ustilago sphaerogena формируется большее число митохондрий, при недостатке Ц. у Euglena gracilis исчезают рибосомы. Ц. необходим для развития яйцеклетки и зародыша (в его отсутствии не образуются семена). Он повышает засухо-, жаро- и холодостойкость растений. Недостаток Ц. ведёт к нарушению деления клеток, различным функциональным болезням — побелению верхушек кукурузы, розеточности растений и др. У животных, помимо участия в дыхании и нуклеиновом обмене, Ц. повышает деятельность половых желёз, влияет на формирование скелета плода. Показано, что недостаток Ц. у грудных крыс уменьшает содержание РНК и синтез белка в мозге, замедляет развитие мозга. Из слюны околоушной железы человека выделен цинксодержащий белок; предполагается, что он стимулирует регенерацию клеток вкусовых луковиц языка и поддерживает их вкусовую функцию. Ц. играет защитную роль в организме при загрязнении среды кадмием.
М. Я. Школьник.
Медицинское значение Ц. Дефицит Ц. в организме ведёт к карликовости, задержке полового развития; при его избыточном поступлении в организм возможны (по экспериментальным данным) канцерогенное влияние и токсическое действие на сердце, кровь, гонады и др. Производственные вредности могут быть связаны с неблагоприятным воздействием на организм как металлического Ц., так и его соединений. При плавке цинкосодержащих сплавов возможны случаи литейной лихорадки . Препараты Ц. в виде растворов (сульфат Ц.) и в составе присыпок, паст, мазей, свечей (окись Ц.) применяют в медицине как вяжущие и дезинфицирующие средства.
А. А. Каспаров, Г. Н. Красовский.
Лит.: Краткая химическая энциклопедия, т. 5, М., 1967; Лакерник М. М., Пахомова Г. Н., Металлургия цинка и кадмия, М., 1969; Севрюков Н. Н., Кузьмин Б. А., Челищев Е, В., Общая металлургия, М., 1976; Парибок Т. А., О роли цинка в метаболизме, в сборнике: Биологическая роль микроэлементов и их применение в сельском хозяйстве и медицине, М., 1974; Ковальский В. В., Геохимическая экология, М., 1974; Школьник М. Я., Микроэлементы в жизни растений, Л., 1974; Пейве Я. В., Микроэлементы и ферменты, в сборнике: Физиологическая роль и практическое применение микроэлементов, Рига, 1976; Bowen Н. J. М., Trace elements in biochemistry, L. — N. Y., 1966; Движков П. П., Соединения цинка, в кн.: Многотомное руководство по патологической анатомии, под ред. А. И. Струкова, т. 8, кн. 1, М., 1962; Вредные вещества в промышленности, под ред. Н. В. Лазарева, [т.] 2, М. — Л., 1965.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОКЧитайте также
цинк
цинк 1. цинковый гроб с останками погибшего в Афганистане, см. также консервы Труп положили в цинк, запаяли. Цинк — в деревянный гроб, а его и фуражку в транспортировочный ящик. В цинке оставили окошко: труп не был изуродован. [3, 159] …ребята говорили, что наши никогда не
Бор (химич. элемент)
Бор (химич. элемент) Бор (лат. Borum), В, химический элемент III группы периодической системы Менделеева, атомный номер 5, атомная масса 10,811; кристаллы серовато-чёрного цвета (очень чистый Б. бесцветен). Природный Б. состоит из двух стабильных изотопов: 10 B (19%) и 11 B (81%). Ранее других
Соль (химич.)
Соль (химич.) Соль, см. Соли, Соли природные, Натрия хлорид.
Цинк (муз. инструмент)
Цинк (муз. инструмент) Цинк (нем. Zink), старинный духовой музыкальный инструмент. Прямой или изогнутый рог из дерева или слоновой кости с 6 отверстиями для изменения высоты звуков. В 16—17 вв. использовался в камерной светской и церковной музыке, применялся также (до 19 в.)