2. Клеточное дыхание работающих мышц
2. Клеточное дыхание работающих мышц
Гипоксия
Гипоксия тканей (кислородная недостаточность) – широко распространенное явление, встречающееся в результате неблагоприятных изменений в окружающей среде, при различных патологических состояниях, а также при тренировочном процессе.
Причины появления гипоксии могут быть различными, но ответная реакция организма носит неспецифический характер и в своем развитии проходит несколько стандартных фаз. На каждой из них происходит последовательное урезание энергетических возможностей. Поэтапное выключение фрагментов дыхательной цепи по мере снижения содержания кислорода в тканях является приспособительной реакцией организма на быстро ухудшающиеся условия среды. Снижение энергопродуцирующих функций клеток до определенного предела имеет обратимый характер, но при интенсивном развитии гипоксии или значительной ее продолжительности изменения приобретают необратимый характер. Знание механизмов повреждения тканей при гипоксии необходимо для наиболее эффективной коррекции этого патологического состояния.
Митохондрии – субклеточные элементы, в которых совершаются основные энергопреобразующие процессы. В последние годы активно разрабатывается новая область медицины – митохондри-альная. Установлено, что более 100 заболеваний вызваны различными нарушениями функционирования митохондрий.
Сегодня устройство митохондриальной дыхательной цепи и механизм ее работы обсуждаются с единых позиций во всех авторитетных изданиях, а четверть века назад на научных конференциях шли ожесточенные споры между представителями различных школ биоэнергетиков.
Английским биохимиком Питером Митчеллом (Mitchell P., 1961) предложена хемиосмотическая гипотеза.
Известно, что окисление дыхательных субстратов кислородом катализируется дыхательными ферментами, расположенными во внутренней мембране митохондрий. По данной гипотезе окисление субстрата ферментом – акцептором электронов – происходит на одной из сторон мембраны. В результате этой реакции электрон присоединяется к ферменту и образовавшийся протон высвобождается из мембраны и уходит в воду. Затем электрон переносится ферментом на другую сторону мембраны, и там он восстанавливает кислород или другой фермент, проявляющий акцепторные свойства к электрону. При восстановлении кислорода или фермента происходит связывание протонов по другую сторону мембраны.
По хемиосмотической гипотезе в процессе дыхания происходит направленный перенос протонов из одного отсека в другой, а разделительная мембрана препятствует восстановлению равновесия между отсеками. Концентрирование протонов по одну сторону мембраны в процессе дыхания представляет собой осмотическую работу по переносу ионов в пространстве против градиента их концентрации. В процессе окисления субстрата и восстановления кислорода совершается также химическая работа.
Главная отличительная особенность мембранных окислительных процессов, подмеченная Митчеллом, заключается в одновременном выполнении двух видов работ – химической и осмотической. Эта особенность и определила название выдвинутой гипотезы.
По этой гипотезе образование АТФ в процессе окислительного расщепления субстрата происходит следующим образом: осмотическая энергия, накопленная в виде разности концентраций протонов между двумя отсеками, разделенными мембраной, расходуется на химическую работу, т е. на синтез АТФ.
Гениальное изобретение природы – система митохондриального окисления субстрата – выполняет не только осмотическую и химическую, но и электрическую работу. Выбрасывая из одного резервуара однозарядные ионы и перенося их через мембрану в другой резервуар, такая система осуществляет зарядку биологической мембраны как электрического конденсатора, когда по разные стороны мембраны концентрируются ионы с противоположными зарядами.
Получил неопровержимое подтверждение фундаментальный факт (Скулачев В.П.), вытекающий из хемиосмотической гипотезы, что сопряжение процессов дыхания и фосфорилирования возможно только при наличии целостной мембраны, надежно разделяющей разнозарядные ионы в своих отсеках. При повреждении мембран различными веществами (в том числе оксидантами) синтез АТФ прекращается.
Основные энергопреобразующие процессы совершаются в митохондриях. Поломка отдельных элементов в этой структуре ведет к нарушению энергетического гомеостаза с серьезными последствиями для клетки, органа или организма в целом. Группа ферментов, локализованная по внутренней мембране митохондрий и участвующая в процессах биотрансформации энергии, получила название дыхательной цепи (см. рис. 3).
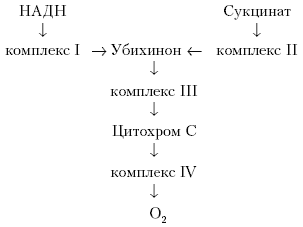
Рис. 3. Упрощенная схема работы дыхательной цепи
Принято считать, что митохондриальная цепь состоит из четырех групп ферментов и белков, компактно локализованных во внутренней мембране митохондрий (Рубин А., Шинкарев В.П.). Подобные группы ферментов принято называть комплексами. Перенос восстановительных эквивалентов от комплекса к комплексу может быть реализован только с использованием низкомолекулярных переносчиков, способных участвовать в окислительно-восстановительных реакциях. Подобных переносчиков в организме известно два: убихинон, цитохром С.
Убихинон обеспечивает связь между комплексом I и II, цитохром С – между III и IV.
Важно отметить, что хотя оба переносчика выполняют сходные функции в общей мембране митохондрии, их работа организована таким образом, что они не мешают друг другу. Убихинон функционирует в толще мембраны, а цитохром С мигрирует по наружной ее поверхности. Пространственное разделение обоих потоков позволяет исключить случаи транспортного хаоса.
В качестве энергетического субстрата комплекс I использует НАНД (никотинамидадениндинуклеотид), образующийся в процессах как аэробного, так и анаэробного окисления субстратов. Комплекс II катализирует реакции окисления сукцината, образующегося в цикле трикарбоновых кислот (цикл Кребса).
Кислород является субстратом митохондриальной дыхательной цепи. Дефицит кислорода ведет к ограничению, а при полном прекращении его поступления в организм к быстрой дезорганизации работы дыхательной цепи, ее мультиферментной системы. Главным результатом в этом случае становится истощение клеточных запасов макроэргов и повреждение энергопребразующих механизмов. Такую гипоксию в настоящее время принято называть биоэнергетической. При нарушении энергетических потоков наступает состояние гипоксии тканей.
В зависимости от причин, вызывающих энергетический дефицит, различают четыре вида гипоксии. По сути, биоэнергетическая гипоксия – обязательный этап в каждом из четырех типов.
Гипоксическая гипоксия возникает при снижении парциального давления кислорода в легочных альвеолах, что чаще всего наблюдается при расстройстве системы внешнего дыхания или при подъеме на высоту, в горах.
Гемическая гипоксия наступает при дефиците или нарушении функционирования эритроцитарных клеток, специализирующихся на доставке кислорода из легких в ткани-потребители. При этом различают анемический тип гемической гипоксии, связанный с уменьшением концентрации гемоглобина, и патологический тип, наблюдаемый при инактивации гемоглобина.
Если гипоксия тканей связана с нарушением кровообращения, выделяют циркуляторную гипоксию. Она может быть связана как с местным, так и системным нарушением кровообращения или с перфузией ткани кровью.
Отдельно рассматривают случаи тканевой гипоксии, когда р02 в крови соответствует норме, гемоглобин эффективно связывает молекулы кислорода, а кровь успешно доставляет его в ткани, но последние не в состоянии его использовать. Тканевая гипоксия наступает при отравлении митохондриальных ферментов дыхательными ядами, например цианидами или угарным газом, при дефиците окислительно-восстановительных ферментов или их посредников, возникающем при гормональной недостаточности, а также при повреждении митохондриальных мембран. К тканевой гипоксии как критическому состоянию приводит любой вид неустойчивой гипоксии.
Гипоксию можно рассматривать как одну из разновидностей стрессорных состояний и в соответствии с законом Селье следует ожидать три фазы ответа организма на стресс.
Первая фаза (возбуждение). Наблюдается усиление активности окисления первичного субстрата и увеличение продукции АТФ. Этой фазе соответствует усиление функциональной активности клеток, в частности интенсификация обменных процессов, в том числе ионного обмена. Происходит мобилизация функций жизненно важных органов. Повышается сократительная активность миокарда, частота сердечных сокращений, артериальное давление. Усиливающуюся гипоксию тканей сердце пытается скомпенсировать увеличением скорости доставки свежих порций крови на периферию. Повышается ответственность за управлением всеми функциями организма со стороны мозга, поэтому растет импульсная активность нейронов, увеличивается частота дыхания. Происходит экстренный выброс гормонов для мобилизации организма к стрессу, в первую очередь для усиления доставки тканям энергетического субстрата. Мобилизуются функции печени для переработки возрастающих потоков недоокисленных метаболитов. Длительность фазы возбуждения определяется продолжительностью гипоксического воздействия и интенсивностью его проявления. Эти процессы определяют суть тренировочного воздействия.
Фаза возбуждения сменяется фазой адаптации. Из-за ограниченности поступления кислорода в ткани происходит постепенное увеличение доли восстановленных форм дыхательных ферментов и ингибирование комплекса I дыхательной цепи. При этом возрастает доля восстановленной формы убихинона – убихинола. Последний является активатором сукцинатдегидрогеназного комплекса. В результате происходит переключение субстратного участка дыхательной цепи с комплекса I на комплекс II, а в клетке начинают накапливаться НАД-зависимые субстраты цикла Кребса. В этот период, несмотря на нарушение работы комплекса I за счет скомпенсированной работы комплекса II, внутриклеточная концентрация АТФ сохраняется неизменной или почти неизменной. При сохранении энергетического гомеостаза функциональная активность клеток также не меняется. Начальный период гипоксии, в течение которого сохраняется состояние энергетического гомеостаза в клетках, относится к компенсированной стадии биоэнергетической гипоксии.
По мере развития гипоксии и снижения запасов кислорода в тканях наблюдается переход к заключительной фазе реакции организма на стресс – фазе истощения. На этой фазе можно выделить два последовательно проходящих этапа деградации электронтранспортных функций митохондрий. На первом этапе наблюдается подавление биоэнергетических функций дыхательной цепи в области комплекса III. Этот период соответствует началу нескомпен-сированных изменений и сопровождается снижением содержания макроэргов в клетках.
Нарушение энергетического гомеостаза – событие с далеко идущими последствиями для клеток. По этой причине в экстренном порядке мобилизуются внутренние резервы для ликвидации энергетического дефицита. Осуществляется запуск запасной биоэнергетической системы – системы анаэробного окисления субстрата. Происходит централизация кровообращения, при которой не «отключаются» от перфузии только сердце, головной мозг и почки – основные жизненно важные системы.
Включение процессов гликолиза происходит в тот момент, когда в клетке снижается содержание АТФ и увеличивается концентрация АДФ и АМФ. Клетка переходит в новое нестабильное состояние и возникает реальная угроза для ее существования. Дальнейшая судьба клетки зависит от энергетических и субстратных потоков, а также от ряда биохимических и биофизических процессов, которые в экстренном порядке запускаются по мере дизэнер-гизации клетки.
По мере развития гипоксии наблюдается поэтапное повреждение элементов дыхательной цепи. После последовательного подавления переноса электронов через комплексы I, II и III в дыхательной цепи сохраняется последняя возможность образования АТФ за счет работы цитохромоксидазы (комплекса IV). Но в условиях усиливающейся гипоксии и дезорганизации работы многих ферменных систем сохранивший работоспособность фрагмент дыхательной цепи уже не способен удовлетворить энергетические запросы клетки. Этому обстоятельству способствует также относительный и абсолютный субстратный дефицит. Как известно, субстрат для комплекса IV – восстановленная форма фермента цитохрома С. Последняя окисляется кислородом с помощью цитохромоксидазы и превращается в окисленную форму фермента. При инактивации комплекса III, в котором обычно осуществлялось ферментативное восстановление окисленной формы фермента, наступает относительный субстратный дефицит. В этих условиях клетка использует запасные механизмы восстановления фермента за счет реакций не ферментативного взаимодействия последнего с убисемихиноном или супероксидным ион-радикалом. Таким образом удается восстановить поставку субстрата для комплекса IV, нарушенную в результате инактивации в комплексе III.
Однако относительный субстратный дефицит вскоре сменяется на абсолютный. Последнее обстоятельство связано с повреждением мембранных структур. По мере поэтапного выключения в условиях гипоксии отдельных комплексов дыхательной цепи наблюдается последовательное снижение сопрягающих функций митохондрий. Открываются протонные каналы во внутренней мембране митохондрий, что обеспечивает на время поступление свежих партий макроэргов. И за их появление приходится платить все более дорогую цену. В результате набухания митохондрий и дальнейшего увеличения размера пор из матрикса в цитоплазму клетки перемещаются различные субстраты и низкомолекулярные белки, включая цитохром С. Потере последнего способствует снижение мембранного потенциала на митохондриальной мембране. Как известно, молекула фермента имеет избыточный положительный заряд и удерживается на внутренней стороне митохондриальной мембраны преимущественно за счет электростатических сил притяжения. По мере снижения величины мембранного потенциала молекулы цитохрома С начинают покидать поверхность мембраны и комплекс IV лишается своего субстрата. Дыхательная активность в этом случае полностью подавляется, и клетка гибнет.
Антигипоксэнты
Антигипоксантами называют средства, улучшающие усвоение организмом кислорода и снижающие потребность органов и тканей в кислороде, тем самым способствующие повышению устойчивости организма к кислородной недостаточности.
Исследования убедительно свидетельствуют, что наиболее перспективны в борьбе с гипоксией в спорте фармакологические средства, воздействующие на митохондриальные комплексы (табл. 12-14).
Условно антигипоксанты могут быть разделены на группы:
– препараты непосредственно антигипоксического действия;
– корригирующие метаболизм в клетке:
• мембранопротекторного действия,
• прямого энергизирующего действия (влияющие на окислительно-восстановительный потенциал клетки, цикл Кребса и комплексы дыхательной цепи митохондрий);
– действующие на транспортную функцию крови:
• повышающие кислородную емкость крови,
• повышающие сродство гемоглобина к кислороду,
• вазоактивные вещества эндогенной и экзогенной природы.
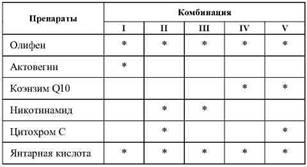
Таблица 12
Биоэнергетическое воздействие отдельных препаратов на коплексы митохондриальной дыхательной цепи
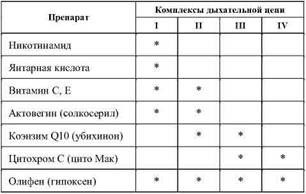
Таблица 13
Применение антигипоксантов
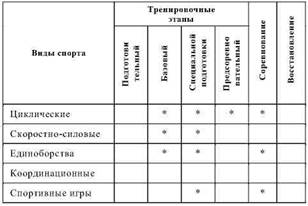
Таблица 14
Антигипоксанты
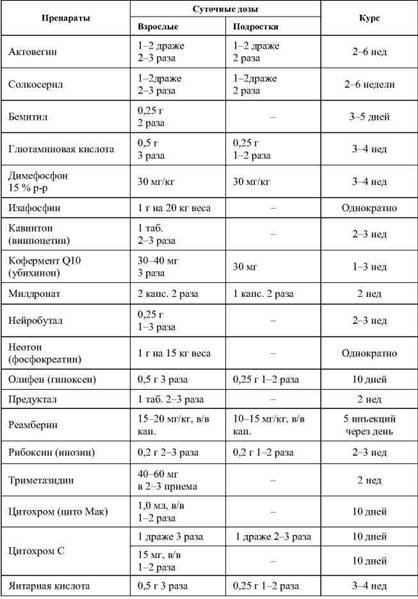
Примечание. Применяется один из представленных в таблице препаратов, оказывающий максимальное действие с минимальными осложнениями и побочными эффектами.
Олифен (гипоксен). Антигипоксант. Механизм действия олифена на клетки заключается в снижении потребления тканями кислорода, его более экономном расходовании в условиях гипоксии.
Олифен – фермент дыхательной цепи синтетической природы. Обладая высокой электронно-обменной емкостью за счет полифе-нольной структуры молекулы, олифен оказывает шунтирующее действие на стадии образования молочной кислоты из пировино-градной кислоты, образуя ацетил Ко А, который затем вовлекается в цикл трикарбоновых кислот. Олифен на молекулярном уровне облегчает тканевое дыхание в условиях гипоксии за счет способности непосредственно переносить восстановленные эквиваленты к ферментным системам. Препарат многократно компенсирует недостаток убихинона в условиях гипоксии, так как содержит большое количество функциональных центров. Таким образом, олифен компенсирует деятельность митохондриальной дыхательной цепи при наличии повреждений на ее участках.
Антиоксидантное действие олифена связано с его полифеноль-ной структурой, которая защищает мембраны клеток и митохондрий от разрушительного воздействия свободных радикалов, образующихся в процессе перекисного окисления липидов. Этот патологический процесс запускается при экстремальных физических и психоэмоциональных воздействиях на организм.
Олифен улучшает переносимость гипоксии за счет увеличения скорости потребления кислорода митохондриями и повышения сопряженности окислительного фосфорилирования.
Будучи препаратом прямого действия, может обеспечить кислородом любую клетку за счет малых размеров собственных молекул. В связи с этим его применение возможно при всех видах гипоксии.
Экономное расходование энергетических запасов происходит за счет переведения с гликолитического на аэробное окисление энергетических субстратов, т е. на более выгодный механизм обмена. При этом выход энергии увеличивается в 19 раз, так как при анаэробном гликолизе одной молекулы получается 2 молекулы АТФ, а при аэробном – 38 молекул АТФ.
Водорастворимый антиоксидант, обладая высокой энергетической емкостью, ставит большое количество электронных ловушек. Окислительно-восстановительный потенциал олифена – 680, коэнзима Q10 – 122.
Показания к применению в спорте: повышение работоспособности при выполнении мышечной работы в экстремальных условиях соревнований; экономное расходование кислорода тканями в условиях гипоксии; профилактика и преодоление состояния хронической усталости; ускорение восстановления организма после перенесенных нагрузок; улучшение периферического кровотока.
Выводится из организма через 6-8 часов.
Побочное действие практически не встречается. В редких случаях возможна тошнота, сухость во рту.
Олифен улучшает усвоение других веществ (лекарств, витаминов) на 25%.
Убихинон (кофермент Q-10, коэнзим Q10) – вещество, которое вырабатывается организмом и поступает с пищей. Оно обнаружено в говядине (особенно во внутренних органах – сердце, печени, почках), жирной рыбе, шпинате, арахисе и цельных зернах. Несмотря на то что коэнзим Q10 (CoQ-10) можно найти во многих свежих продуктах, он неустойчив и легко разрушается окислением при переработке и приготовлении продуктов.
CoQ-10 участвует в работе электронтранспортной дыхательной цепи митохондрий. Уменьшает повреждение ткани, вызванное гипоксией, генерирует энергию и повышает толерантность к физическим нагрузкам. Как антиоксидант замедляет процесс старения (нейтрализует свободные радикалы, отдавая свои электроны). Укрепляет иммунную систему.
Наш организм может вырабатывать CoQ-10, если получает в необходимом количестве витамины В2, В3, В6, С, фолиевую и пантотеновую кислоты. В случае нехватки любого из этих витаминов синтез CoQ-10 подавляется.
Не имеет токсичных доз и побочных эффектов.
CoQ-Ю принимается в дозировке от 30 до 100 мг в день.
Никотинамид. Амид никотиновой кислоты и сама никотиновая кислота (витамин РР, ниацин, витамин В3), являясь простетической группой ферментов НАД и НАДФ и переносчиками водорода, участвуют в процессах тканевого дыхания, метаболизме жиров, углеводов, аминокислот.
Цитохром С (цито Мак). Гемопротеид, катализатор клеточного дыхания. Стимулирует окислительные реакции и активизирует тем самым обменные процессы в тканях, уменьшает гипоксию тканей при различных патологических состояниях. Эффект наступает через несколько минут после в/в введения и продолжается несколько часов.
При применении возможны аллергические реакции. Предрасположенным к аллергическим реакциям рекомендуется проводить пробу с введением 0,5-1 мл цитохрома С, разбавленного 1:10; или 0,1 мл внутрикожно.
Реамберин. Раствор (1,5%) для инфузий представляет собой хорошо сбалансированный полиионный раствор с добавлением янтарной кислоты, содержащий: натрия хлорида 6,0 г, калия хлорида 0,3 г, магния хлорида 0,12 г, натриевой соли янтарной кислоты 15 г, воды для инъекций до 1 литра. Сбалансированный препарат с осмолярностью, приближенной к нормальной осмолярности плазмы крови человека.
Основной фармакологический эффект препарата обусловлен способностью усиливать компенсаторную активацию аэробного гликолиза, снижать степень угнетения окислительных процессов в цикле Кребса, в дыхательной цепи митохондрий с увеличением внутриклеточного фонда макроэргических соединений (АТФ и креатин-фосфата). Сукцинат натрия (янтарная кислота) по клинической классификации относится к субстратным антигипоксантам. Включаясь в энергетический обмен как субстрат, соли янтарной кислоты направляют процессы окисления по наиболее экономичному пути.
Реамберин оказывает гепатозащитное действие, уменьшая продолжительность процессов перекисного окисления липидов и препятствуя истощению запасов гликогена в клетках печени.
Максимальный уровень концентрации препарата в крови при внутривенном введении наблюдается на первой минуте после введения. Через 40 мин его концентрация возвращается к значениям, близким к фоновым.
Инозин (рибоксин). Действие инозина антигипоксическое, антиаритмическое, анаболическое. Повышает активность ряда ферментов цикла Кребса и энергетический баланс. Оказывает положительное влияние на обменные процессы в миокарде – увеличивает силу сокращений и способствует более полному расслаблению миокарда в диастоле (связывает ионы кальция, попавшие в цитоплазму в момент возбуждения клетки), в результате чего возрастает ударный объем; улучшается кровоснабжение тканей, в том числе коронарное кровообращение.
Используется для профилактики метаболических нарушений в миокарде при экстремальных физических нагрузках, при дистрофии миокарда на фоне тяжелых физических нагрузок, нарушениях сердечного ритма, для профилактики заболеваний печени.
При применении возможны тахикардия, обострение подагры, гиперемия и зуд кожи, другие аллергические реакции.
Актовегин (солкосерил). Препарат биологического происхождения. Активирует клеточный метаболизм путем увеличения транспорта и накопления глюкозы и кислорода, усиления внутриклеточной утилизации. Улучшает трофику и стимулирует процесс регенерации.
Милдронат. Улучшает метаболические процессы. Повышает работоспособность, уменьшает симптомы психического и физического перенапряжения; обладает кардиопротекторным и регулирующим систему клеточного иммунитета действиями; устраняет функциональные нарушения в соматической и вегетативной нервной системах. Препарат вызывает уменьшение содержания свободного кар-нитина, снижает карнитинзависимое окисление жирных кислот.
Биодоступность – 78%. Максимальная концентрация в плазме достигается через 1 –2 часа после приема. Период полувыведения – 3-6 часов.
Используется для восстановления после тренировочной и соревновательной нагрузки; физическом перенапряжении, перетренированности.
В редких случаях возможен кожный зуд, диспептические явления, тахикардия, возбуждение, изменения АД.
Применять осторожно при тахикардии и гипотензии.
Кавинтон (винпоцетин). Препарат, улучшающий мозговое кровообращение и процессы метаболизма в мозговой ткани; способствует транспортировке кислорода к тканям вследствие уменьшения сродства к нему эритроцитов, усиливая поглощение и метаболизм глюкозы; уменьшает повышенную вязкость крови, улучшает микроциркуляцию. Метаболизм глюкозы переключается на энергетически более выгодное аэробное направление. Стимулирует также и анаэробный метаболизм глюкозы.
Назначается в случае острой и хронической недостаточности мозгового кровообращения (транзиторная ишемия в видах спорта на выносливость); посттравматической и гипертензивной энцефалопатии (травмоопасные виды спорта); для уменьшения нарушений памяти; при головокружении; головной боли; двигательных расстройствах.
Антигипоксическим эффектом обладают также витамины С и Е, адаптогены, ноотропы, оксибутират лития, лимонная и фумаровая кислоты.
При комбинированном применении антигипоксантов происходит усиление их действия (см. рис. 3 и табл. 15).
Таблица 15
Возможные комбинации антигипоксических препаратов
Гипоксическая гипоксия возникает при снижении р02 в легочных альвеолах, крови, клетках тканей, что чаще всего наблюдается при расстройстве системы внешнего дыхания (заболевания легких, бронхов; слабость дыхательных мышц, диафрагмы и т. п.) или при подъеме на высоту, в горах.
Тренировка дыхательных мышц и устойчивости к повышенному количеству углекислого газа (С02) в организме возможна с помощью дыхательных тренажеров.
Гипоксическая тренировка проводится как самостоятельная (на тренажере) и как дополнение к основной тренировке в виде серии задержек дыхания с интервалом 1-3 мин (после основной тренировки). То же относится к специальной подготовке при планировании тренировок в горах.
Поиск путей совершенствования системы подготовки спортсменов высокой квалификации к соревнованиям привел к методике тренировки в горных условиях как дополнительному средству повышения спортивной работоспособности. Подготовка спортсмена в горах подразумевает определенный сдвиг физиологических констант организма.
По степени воздействия выделяют:
низкогорье – 1000—1400 м над уровнем моря;
среднегорье – до 2500 м;
высокогорье – до 4500 м;
снежное высокогорье – выше 4500 м над уровнем моря.
Обычно горные условия используют с целью:
– выступления на соревнованиях на аналогичной высоте;
– выступления в серии соревнований, проводящихся на разных высотах;
– повышения спортивных достижений при спуске на равнину.
Чаще всего горную подготовку применяют с последней целью.
Низкогорье (предгорье) эффективно после возвращения на равнину, главным образом, не за счет адаптации к гипоксическому фактору, а в связи с воздействием комплекса климатических модификаторов, характерных для этих высот.
Высокогорье, кроме значительно сниженного атмосферного давления и парциального давления кислорода, воздействует на состояние спортсмена перепадом температур, пониженной влажностью.
Для получения эффекта горной подготовки используют в основном среднегорье.
Среднегорье предъявляет повышенные требования к функционированию организма спортсмена вследствие изменения парциальных давлений газов атмосферы. Атмосферное давление снижается по мере возрастания высоты, но процентное соотношение газов в воздухе остается постоянным. Воздух всегда содержит 20,94% кислорода, 0,03% углекислого газа, 78,08% азота, 0,94% аргона и 0,01% других газов. Давление, которое производят молекулы кислорода, непосредственно связано с плотностью атмосферы. Изменение давления кислорода напрямую влияет на циркуляцию кислорода между легкими и кровью и между кровью и клетками тканей.
По определению максимальное потребление кислорода соответствует возможности организма его получить, переработать и использовать. Диффузия кислорода в кровь зависит от р02 в альвеолах легких, которое снижается по мере набора высоты, приводя к уменьшению насыщения крови оксигемоглобином. На уровне моря оксигемоглобин составляет 98%, но каждые 400 м он падает на 1%.
На уровне моря перепад р02 в крови и клетках тканей – 74 мм рт. ст. (94 мм рт. ст. – р02 в артериальной крови, 20 мм рт. ст. – в клетках тканей). Этот перепад – основной фактор, отвечающий за насыщение тканей кислородом[4]. На высоте около 7000 м перепад очень незначительный и, следовательно, ткани почти перестают «дышать». Но, например, на уровне 2400 м р02 в крови (артериальной) составляет около 60 мм рт. ст., в то время как в клетках оно остается на уровне 20 мм рт. ст. Разница составляет только 40 мм рт. ст., т е. спад в насыщении тканей кислородом на этой высоте составляет около 50%.
По мере того как р02 падает, стимулируется вентиляция легких. Это вызывает повышенное выделение С02 и респираторный алкалоз. Выделяется и остается на низком уровне бикарбонат, снижается буферная емкость, повышается рН крови.
Поглощение кислорода клетками мышц на высоте снижается, но после продолжительного пребывания в этих условиях немного увеличивается. В организме возникает ряд защитных компесаторно-приспособительных реакций. В первую очередь недостаток 02 приводит к возбуждению хеморецепторов. Их возбуждение служит сигналом для углубления и учащения дыхания. Увеличивается альвеолярная поверхность, что способствует более быстрому насыщению гемоглобина кислородом. К тому же гипоксия, которая усиливается во время напряженной работы на высоте, мешает тренироваться с адекватной интенсивностью и в нужном объеме[5] (табл. 16).
Так как кислородные возможности на высоте ограничены, то при любой заданной рабочей нагрузке выработка молочной кислоты выше, чем на уровне моря[6]. Сердечная деятельность на высоте усиливается, пытаясь компенсировать сокращенное питание тканей кислородом. Таким образом создаются условия для перенапряжения сердечно-сосудистой и центральной нервной систем. Вторично страдают насыщенные сосудами органы.
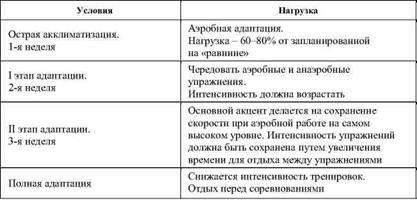
Таблица 16
Тренировочный режим в горах
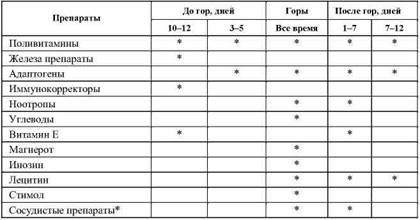
Фармакологическую коррекцию необходимо начинать за 10-12 дней до дня переезда. Препараты железа, магния в профилактических дозах. Адаптогены. Иммунокорректоры. Для профилактики сердечно-сосудистых осложнений назначаются препараты, улучшающие реологические свойства крови, обменные процессы в сердечной мышце. Анаболические средства – оротат калия, магнерот, трибулус, левзея, флавостен. Улучшающие усвоение глюкозы и кислорода: янтарная кислота, глютаминовая кислота, коэнзим Q-10. Витамины – суточная потребность в большинстве из них в горах возрастает в 1,5-2 раза. Углеводы (преимущественно в виде напитков) – спортивные напитки, напитки из фруктозы, меда (насыщение во время тренировок).
Фармакологическая поддержка во время тренировок в горах должна соответствовать этапу подготовки (табл. 17, 18).
Таблица 17
Фармакология при тренировке в горах и соревнованиях на равнине
* Препараты улучшающие микроциркуляцию.
Фармакотерапия после спуска на «равнину» должна быть направлена на повышение функциональных возможностей спортсмена и предупреждение срыва процессов реадаптации. Необходимо продолжить применение препаратов, улучшающих микроциркуляцию и реологические свойства крови. Адаптогены назначаются в половинной дозе от той, что применялась в горах. Следует усилить витаминизацию, обращая особое внимание на витамин Е, обладающий антиоксидантными свойствами, предотвращающий быстрое разрушение эритроцитов. Необходимо также поддержать функцию сердца, печени, почек.
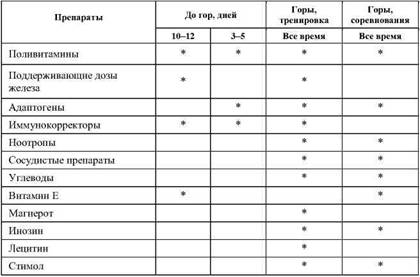
Таблица 18
Фармакология при тренировке в горах и соревнованиях в горах
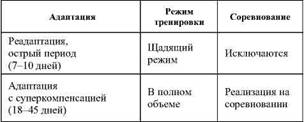
При возвращении на равнину первые 7 дней («острый период») идет процесс реадаптации с ухудшением спортивных результатов и риском возникновения заболеваний (особенно 3-4-й день); далее следует подъем работоспособности. Пик результативности (индивидуален по срокам) возможен на 18-30-й день (табл. 19).
Молодые спортсмены без горного стажа в процессе адаптации более сильно реагируют на тренировочные нагрузки, что удлиняет сроки «острой» акклиматизации. Благоприятно влияют на адаптацию горный стаж и степень подготовленности спортсмена.
Таблица 19
Реадаптация после гор
Гемическая гипоксия. Гемоглобин (hb) в эритроцитах – средство доставки кислорода и удаления углекислого газа из тканей. Повышение кислородной емкости крови за счет увеличения уровня Hb – один из способов коррекции гипоксии. Hb, состоящий из гема и глобина, для своего образования в качестве пластического материала требует железо, аминокислоты, витамины (цианкобаломин, фолиевая кислота и др.).
Кроме Hb железо присутствует в миоглобине миофибрилл мышц, участвует во множестве биохимических реакций как катализатор.
Дефицит железа в организме возможен при: недостатке железа в пищевом рационе; нарушении усвоения железа; при повышенных потерях железа с потом, мочой; перераспределении белка, железа в пользу рабочей гипертрофии мышц; физиологических потерях Hb у спортсменок.
Кроме того, возможно относительное снижение концентрации Hb в крови за счет увеличения объема циркулирующей плазмы, т е. разведения его в большем объеме.
Истощение запасов железа в организме спортсмена приводит:
а) к снижению уровня физической работоспособности за счет:
– эргометрических показателей,
– изменения газовых градиентов организма (кислорода и углекислоты),
– накопления молочной кислоты;
б) к перетренированности.
Контроль Hb в циклических видах спорта необходимо осуществлять ежемесячно. Для выявления скрытого дефицита железа используются углубленные методы исследования.
Коррекция должна начинаться сразу после выявления дефицита железа:
1) возмещение дефицита железа в крови и тканях препаратами;
2) восстановление метаболизма в эритроцитах и других клетках;
3) коррекция причин, лежащих в основе дефицита железа.
Мероприятия проводятся до нормализации состояния спортсмена, полного восстановления как Hb (минимум 140 г/л), так и «железа запасов» (уровень ферритина) с помощью витаминизации и приема анаболических препаратов растительного происхождения, антиоксидантов. В начале цикла подготовки спортсмена к соревнованиям необходимо провести несколько курсов для создания достаточных запасов железа. Женщинам проводят два курса базовой профилактики в течение сезона.
Предпочтение следует отдавать тем препаратам, которые наряду с железом содержат минералы, способствующие лучшему его усвоению.
Хорошей антианемической активностью обладают: актиферрин, конферон, сорбифер дурулес, тотема, фенюльс, ферретаб, феррокаль, ферроплекс, феррофольгамма; препараты с пролонгированным действием: ферроградумет, тардиферон, ферроград 500.
Тотема. Комбинированный препарат, содержащий микроэлементы: железо в виде глюконата, марганец, медь.
Железо, входящее в состав препарата, быстро восполняет нехватку этого элемента в организме, стимулирует эритропоэз. После курса препарата происходит постепенная регрессия клинических (слабость, утомляемость, тахикардия) и лабораторных симптомов анемии. Марганец и медь являются важной составной частью ферментативных систем, участвующих в основных окислительно-восстановительных процессах в организме.
Показания в спорте: повышенное потребление железа при физической нагрузке, недостаточное поступление железа с пищей, повышенная потеря железа на тренировках и соревнованиях при неблагоприятных условиях, профилактика железодефицитной анемии у спортсменов из группы повышенного риска, лечение железодефицитной анемии.
Применение. Содержимое ампул растворяют в воде (с сахаром или без) или в любой другой питьевой жидкости, не содержащей спирт. Желательно принимать препарат натощак. В процессе лечения время приема препарата и режим дозирования корректируют в зависимости от индивидуальной переносимости пациента (возможного побочное действие со стороны ЖКТ).
В профилактических целях назначают 50 мг элементарного железа в сутки в течение 1-3 месяцев.
Детям назначают по 5-10 мг на кг массы тела элементарного железа в сутки.
Взрослым для лечения анемии: 100—200 мг элементарного железа в сутки. Срок лечения зависит от исходного уровня Hb и соответствует 1-2 месяцам. При необходимости препарат может применяться более длительное время.
Установлено, что избыточное потребление чая подавляет всасывание железа. При курсовом применении препарата возможно окрашивание кала в черный цвет.
Контроль лабораторных показателей: уровень гемоглобина, количество эритроцитов, цветовой показатель, средний объем эритроцитов, содержание железа в сыворотке крови.
Нарушение процессов адаптации к физическим нагрузкам со стороны крови может сопровождаться появлением жалоб, функциональными расстройствами со стороны внутренних органов (висцеропатии): нарушением процессов реполяризации в сердечной мышце, дискинезией желчевыводящих путей, доброкачественной гипербилирубинемией, гиперферментемией, ЛОР-заболева-ниями.
Обоснованными методами лечения при наличии висцеропатии, обусловленных дефицитом железа, считаются комплексное использование эссенциальных фосфолипидов, кислородсберегающих метаболических средств (милдронат, предуктал), мембраностаби-лизаторов на фоне базисной терапии ферропрепаратами и антиок-сидантами. Срок лечения зависит от исходного уровня гемоглобина и соответствует 1-2 месяцам.
При сохраняющемся дефиците железа проведение курсами поддерживающей терапии продолжается.
Сохранение параметров красной крови гарантирует оптимальное функционирование всей системы кислородного транспорта.
При исседовании показателей красной крови ориентируются на уровень гемоглобина, количество эритроцитов, ретикулоцитов, гематокрит, железо сыворотки, а также возраст эритроцитов.
Эритроциты – не однородная масса клеток. Они образуют по-пуляционную систему, в которой закономерно сочетаются клетки различного состояния. Эритроциты характеризуют размер (объем), количество в них гемоглобина, стойкость мембран. Разрушение и последующая «утилизация» эритроцита происходит после исчерпания им своих функциональных возможностей или в результате повреждающих патогенных факторов.
Длительность жизни эритроцитов в среднем составляет 110—120 дней и чаще всего зависит от количества контактов гемоглобина с кислородом и стойкости эритроцитарной оболочки.
Под влиянием физической нагрузки возраст эритроцитов может меняться как в сторону старения, так и в сторону омоложения.
По стандартной методике принято разделять эритроциты на три группы по функциональному состоянию и стойкости по отношению к внешним повреждающим факторам, что в норме соответствует (по мере созревания) трем возрастным группам эритроцитов.
Эритрограмма дает представление о физиологическом возрасте эритроцитов.
Молодые эритроциты (юные) – возраст до 28-30 дней. Содержание в норме 20-25%. Группа особо стойких эритроцитов.
Зрелые эритроциты – возраст 30-90 дней. Содержание в норме 45-55% всех клеток. В этом статусе эритроцит проводит большую часть жизни. Зрелые эритроциты наиболее полно участвуют в транспорте и обмене кислорода.
Эритроциты, возраст которых больше 90 дней (20-25%), – группа низкостойких эритроцитов.
Под влиянием физических нагрузок могут происходить изменения в характере эритрограммы в виде смещения максимума по группам.
Сдвиг максимума эритроцитов в сторону физиологического старения может быть связан с физическим переутомлением, угнетающим процессы эритропоэза.
Сдвиг максимума эритрограммы в сторону омоложения эрит-роцитарного состава крови (связан с стимуляцией процесса эритропоэза) указывает на адекватность предложенных тренировочных нагрузок.
Резкое снижение количества зрелых эритроцитов обусловлено понижением резистентности эритроцитарных мембран, что встречается при несоответствии физической нагрузки функциональному состоянию организма спортсмена.
Наличие в кровяном русле эритроцитов нескольких групп с резко различными свойствами (на эритрограмме отчетливо проявляются несколько максимумов) свидетельствует о глубоких нарушениях равновесия системы крови (характерно для перетренированности).
Наиболее адекватная реакция на предлагаемую физическую нагрузку – нормальное (без сдвига) сочетание количества эритроцитов всех возрастов или некоторое омоложение эритроцитарно-го состава крови.
Имеется индивидуальная склонность к явлениям старения или омоложения эритроцитов на протяжении тренировочного «сезона».
Количество эритроцитов в крови и содержание гемоглобина в них зависят от вида спорта, разряда (спортивных достижений), уровня тренированности, места проживания и пола спортсмена (Макарова Г.А., 1990).
Учет резервов системы красной крови позволяет адаптировать организм спортсмена к продолжительным, интенсивным нагрузкам, поддерживать оптимальное функционирование всей системы кислородного транспорта.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОКДанный текст является ознакомительным фрагментом.
Читайте также
Дыхание
Дыхание Дыхание -- один из наиболее важных аспектов ведения боя. Правильное дыхание обеспечивает мышечное расслабление и повышает скорость ваших защитных и атакующих реакций. Оно зависит, прежде всего, от вашего физического состояния и эмоционального настроя. Поэтому
Дыхание
Дыхание Внимательно наблюдая за движениями грудной клетки и живота, несложно определить тип дыхания, его частоту, глубину и ритм. Тип дыхания может быть грудным, брюшным или смешанным. Грудной тип дыхания.Дыхательные движения грудной клетки осуществляются в
10.3.2. Искусственное дыхание
10.3.2. Искусственное дыхание «Рот в рот» (рисунок 10.2 а). Быстро и осторожно уложить пострадавшего на спину на плоскую твердую поверхность с вытянутыми вдоль туловища руками. Освободить грудную клетку от ремней, обвязок, одежды. Голову пострадавшего запрокинуть кверху,
1.2. Признаки и свойства живого: клеточное строение, особенности химического состава, обмен веществ и превращения энергии, гомеостаз, раздражимость, воспроизведение, развитие
1.2. Признаки и свойства живого: клеточное строение, особенности химического состава, обмен веществ и превращения энергии, гомеостаз, раздражимость, воспроизведение, развитие Основные термины и понятия, проверяемые в экзаменационной работе: гомеостаз, единство живой и
Дыхание пустыни
Дыхание пустыни Воины персидского царя Камбиса с трудом продвигались вперед. Вокруг, насколько хватал глаз, лежали гряды песков.Завоевав в 525 году до н. э. Египет, повелитель персов не поладил с его жрецами. Служители храма бога Амона напророчили ему скорую гибель, и
Увольняйте упрямых плохо работающих сотрудников
Увольняйте упрямых плохо работающих сотрудников Иногда менеджеры говорят мне: «Я очень хочу уволить подчиненного, но мы и без того недоукомплектованы и перегружены работой. Я не могу позволить себе избавиться от плохих работников, потому что остальным придется работать
Права, гарантии и льготы для работающих беременных женщин
Права, гарантии и льготы для работающих беременных женщин Работницы «в положении» могут рассчитывать на:– перевод на более легкую работу (запрещается труд при неблагоприятных факторах: например с тяжестями или в условиях облучения);– снижение норм выработки и норм