§ 52 Строение и свойства неорганических веществ. Кислоты и основания
Вещества органические и неорганические.
Все существующие в природе химические вещества можно разделить на органические и неорганические. Все органические вещества являются сложными, т. е. состоят из атомов более чем одного элемента, и одним из этих элементов обязательно является углерод. Неорганические вещества могут быть как простыми, так и сложными. При этом они за некоторыми исключениями не содержат в своём составе углерода. Такими исключениями являются углекислый газ (CO2), угарный газ (CO), угольная кислота (H2CO3) и её производные, карбиды, представляющие собой соединения углерода с некоторыми другими элементами, и ещё небольшое количество веществ. Эти вещества, хотя и содержат в своём составе углерод, органическими не являются.
Простые неорганические вещества.
Простые неорганические вещества делят на металлы и неметаллы. Металлы обладают сходными физическими свойствами – металлическим блеском, способностью проводить теплоту и электрический ток. Типичные металлы пластичны, их можно подвергать ковке и прокатке, вытягивать из них тонкую проволоку. Металлами являются, например, литий (Li), натрий (Na), калий (K), кальций (Ca), магний (Mg), цинк (Zn), алюминий (Al), железо (Fe), марганец (Mn). Неметаллы, как правило, не проводят или плохо проводят электрический ток, в твёрдом состоянии являются хрупкими веществами. Многие простые вещества-неметаллы в обычных условиях газообразны. Неметаллами являются, например, хлор (Cl2), фтор (F2), кислород (O2), сера (S), фосфор (P). Чёткой границы между металлами и неметаллами нет. Так, некоторые неметаллы (графит, иод) обладают блеском и способностью проводить электрический ток, хотя их электропроводность всё равно в десятки тысяч раз ниже, чем у металлов. Среди неметаллов выделяют особое семейство – благородные газы: гелий (He), неон (Ne), аргон (Ar), криптон (Kr), ксенон (Xe), радон (Rn). Валентная электронная оболочка их атомов полностью заполнена, поэтому эти вещества почти не обладают химической активностью. Благодаря этой особенности благородные газы используют для создания инертной атмосферы. Например, гелий используют для наполнения летательных аппаратов и детских воздушных шариков, с помощью аргона и криптона создают защитную атмосферу в лампах накаливания и т. д.
Сложные неорганические вещества: кислоты и основания.
Среди сложных неорганических веществ большой интерес представляют кислоты и основания (щёлочи). В состав кислот входят атомы водорода, способные в ходе электролитической диссоциации отщепляться в виде ионов Н+ от остальной части молекулы. Наиболее известными кислотами являются серная (H2SO4), азотная (HNO3), фосфорная (H3PO4), угольная (H2CO3), соляная (HCl). При электролитической диссоциации кислот образуются положительно заряженные ионы водорода Н+ (катионы) и отрицательно заряженные анионы (HSO-4 или SO2-4, H2PO4, Cl- и т. д.), которые называют кислотными остатками. Таким образом, в растворах, содержащих кислоты, всегда присутствует большое количество ионов водорода. Чем больше концентрация ионов водорода в растворе, тем большей кислотностью он обладает.
При электролитической диссоциации оснований в качестве аниона образуется отрицательно заряженный ион ОН-, который называют гидроксилом или гидроксид-ионом. К основаниям относятся гидроксиды натрия (NaOH), калия (KOH), кальция (Ca(OH)2) и др. Растворимые в воде основания называют щелочами.
Одновременно слабой кислотой и слабым основанием является вода. В обычных условиях вода очень слабо диссоциирует с образованием ионов Н+ и ОН-. Содержание ионов в ней мало, поэтому вода плохо проводит электрический ток. В 1 л чистой воды при комнатной температуре содержится 10—7 моль, т. е. 6,02 1016 катионов водорода и такое же количество гидроксид-ионов. Среду, в которой концентрации ионов Н+ и ОН- равны, называют нейтральной. Если концентрация ионов водорода [H+] в растворе превышает концентрацию гидроксид– ионов [OH– ], то раствор имеет кислотную среду, а если больше гидроксид-ионов [OH– ] – щелочную.
Степень кислотности или щёлочности раствора характеризуют так называемым водородным показателем – рН. Он представляет собой взятый с обратным знаком показатель степени концентрации ионов водорода в растворе, выраженный в моль/л.
В нейтральной среде [H+] = [OH– ], pH = 7,0 (чистая вода).
В кислотной среде [H+] > [OH – ], pH < 7,0.
В щелочной среде [H+] < [OH– ], pH > 7,0.
В желудочном соке человека содержится соляная кислота, которая диссоциирована на ионы H+ и Cl-. Концентрация ионов водорода в желудочном соке равна 0,01 или 10-2 моль/л. Это значительно больше, чем их концентрация в воде. Поэтому желудочный сок является очень кислым, а его рН ? 2,0.
В щелочных растворах концентрация ионов водорода снижена и соответственно повышено содержание ионов ОН-. Например, кровь человека обладает слабой щелочной реакцией (рН ? 7,3–7,5). Большинство употребляемых в пищу продуктов и напитков имеют слабокислую реакцию. Так, рН яблочного сока около 3, кофе – примерно 5, чая – около 6, а молока – чуть меньше 7. Щелочной реакцией обладает раствор питьевой соды, растворы мыла и стиральных порошков.
Некоторые вещества способны менять свой цвет в зависимости от кислотности среды. В химии такие вещества используют в качестве индикаторов, с помощью которых можно различить кислые, щелочные и нейтральные растворы. Примерами индикаторов являются фенолфталеин и лакмус. Однако увидеть подобную реакцию можно при помощи обычных продуктов. Возьмите немного вишнёвого, клюквенного или другого красного сока и капните в него немного раствора пищевой соды. Сок немедленно изменит цвет на синий или фиолетовый. Это происходит потому, что при добавлении соды создаётся щелочная реакция, и содержащийся в соке пигмент теряет красную окраску, которой он обладал в кислой среде.
Не все кислоты и основания в равной степени способны к диссоциации. Те из них, значительная часть молекул которых распадаются при растворении в воде на ионы, называют сильными кислотами или сильными основаниями соответственно. Те, в которых диссоциирует лишь небольшая часть молекул, называют слабыми кислотами или слабыми основаниями. Так, соляная, серная и азотная кислоты – сильные, а угольная кислота – слабая.
Гидроксиды натрия и калия являются сильными основаниями, а нашатырный спирт (раствор аммиака в воде) – слабым основанием. Сильные кислоты и щёлочи обладают очень высокой химической активностью, способны растворять и разрушать многие материалы, а их соприкосновение с кожей или со слизистыми оболочками могут вызвать ожоги (рис. 136).
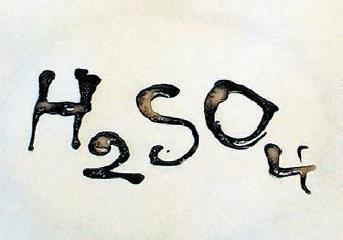
Рис.135. Обугливание бумаги. концентрированной серной кислотой
Проверьте свои знания
1. На какие ионы диссоциируют кислоты и основания при растворении в воде?
2. Как изменяется значение pH в зависимости от степени кислотности или щёлочности растворов? Чему равен pH чистой воды?
3. Какие из пищевых или бытовых веществ имеют кислую, а какие – щелочную реакцию?
4. Чем различаются сильные и слабые кислоты и основания?
Задания
1. Подберите эпиграф к данному параграфу.
2. Проверьте опытным путём, как изменяется окраска вишнёвого или черничного сока при добавлении к ним слабых растворов уксуса и питьевой соды. Сделайте вывод.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОК