§ 58 Соединения, необходимые для существования жизни: белки, липиды
Белки.
Одними из наиболее важных биополимеров, без которых невозможно представить себе существование жизни, являются белки. Мономеры белков – это аминокислоты. Аминокислота обязательно имеет в своём составе карбоксильную группу (—СООН) и аминогруппу (—NH2) (рис. 152). R – это радикал, который может быть просто атомом водорода, а может представлять собой сложное органическое соединение. В состав белков живого организма входит двадцать аминокислот, отличающихся по строению радикала.
В молекуле белка аминокислоты соединены пептидной связью, которая образуется между карбоксильной группой одной аминокислоты и аминогруппой другой (см. рис. 152). При образовании такой связи от карбоксильной группы отщепляется гидроксил, от аминогруппы – атом водорода, а освободившиеся валентные связи углерода и азота соединяют остатки двух аминокислот. Гидроксильная группа и водород взаимодействуют друг с другом, образуя молекулу воды. Таким образом, синтез белка – это реакция поликонденсации. Вещество, состоящее из последовательности аминокислот, соединённых пептидными связями, называют пептидом. Молекула из двух аминокислотных остатков – это дипептид, из трёх – трипептид и т. д. Если аминокислотных остатков в пептиде много, его называют полипептидом. Число аминокислотных остатков в молекуле белка может варьировать от нескольких сотен до нескольких тысяч. Какой бы длинной ни была полипептидная цепь, она никогда не разветвляется и всегда начинается с аминогруппы (N-конец цепи), а заканчивается карбоксильной группой (C-конец цепи).
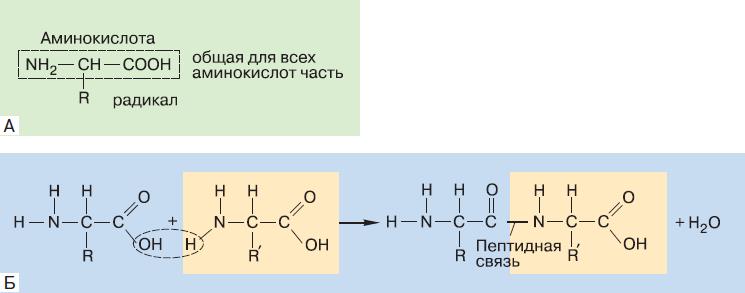
Рис. 152. Общая структурная формула аминокислот, входящих в состав белков (А), и образование пептидной связи (Б)
Линейная последовательность аминокислот в белковой цепи – это первичная структура белка (рис. 153). Она уникальна для любого типа белка и определяет форму его молекулы, свойства и функции. Цепочка из аминокислотных остатков либо складывается зигзагом, либо сворачивается в спираль, формируя вторичную структуру. Эта структура возникает в результате образования связей между группами = С=О и H – N = разных аминокислотных остатков полипептидной цепи.
Складчатая или спиральная молекула сворачивается дальше, образуя третичную структуру. Прочность третичной структуры обеспечивается ионными, водородными, дисульфидными и другими связями. Свёрнутую спираль полипептида обычно называют глобулой (от лат. globulus – шарик). В форме третичной структуры белок уже может выполнять свои функции.
Некоторые белки имеют ещё и четвертичную структуру, которая образуется при соединении нескольких глобул. Например, гемоглобин человека представляет собой комплекс из четырёх таких субъединиц.
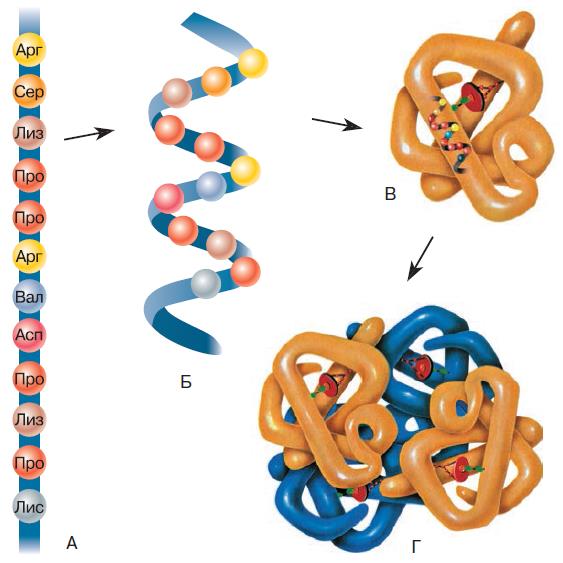
Рис. 153. Первичная (А), вторичная (Б), третичная (В) и четвертичная (Г) структуры белка
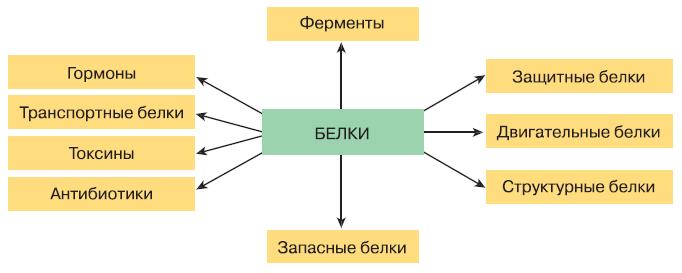
Рис. 154. Функции белков
Огромное разнообразие белковых молекул подразумевает столь же широкое разнообразие их функций (рис. 154). Около 10 000 белков– ферментов служат катализаторами химических реакций. Вторая по величине группа белков выполняет структурную и двигательную функции. Белки участвуют в образовании всех мембран и органоидов клетки. Белок коллаген входит в состав межклеточного вещества соединительной и костной ткани, а основным компонентом волос, рогов и перьев, ногтей и копыт является белок кератин. Сократительную функцию мышц обеспечивают белки актин и миозин. Транспортные белки связывают и переносят различные вещества и внутри клетки, и по всему организму. Белки-гормоны обеспечивают регуляторную функцию.
При попадании в организм человека чужеродных белков, вирусов или бактерий на защиту встают иммуноглобулины – защитные белки. Фибриноген и протромбин обеспечивают свёртываемость крови, предохраняя организм от кровопотери. Белками являются сильные микробные токсины, например ботулиновый, дифтерийный, холерный.
При нехватке пищи в организме животных начинается активный распад белков до конечных продуктов, и тем самым реализуется энергетическая функция этих веществ.
Утрату белковой молекулой своей структурной организации: четвертичной, третичной, вторичной, а при более жёстких условиях – и первичной структуры называют денатурацией (рис. 155). В результате денатурации белок теряет способность выполнять свою функцию. Причинами денатурации могут быть, например, нагревание, ультрафиолетовое излучение.
Денатурация может быть обратимой и необратимой. Если при воздействии денатурирующих факторов разрушения первичной структуры молекулы не произошло, при наступлении благоприятных условий денатурированный белок может вновь восстановить свою трёхмерную форму.
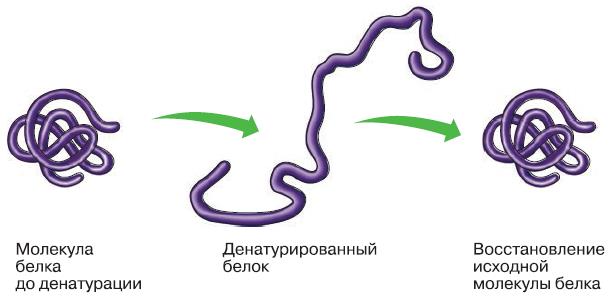
Рис. 155. Денатурация белка
Этот процесс называют ренатурацией, и он убедительно доказывает, что третичная структура белка зависит от последовательности аминокислотных остатков, т. е. от его первичной структуры.
Липиды.
Среди низкомолекулярных органических соединений, входящих в состав живых организмов, важную роль играют липиды. К этой группе относят жиры, воски и различные жироподобные вещества. Это гидрофобные соединения, нерастворимые в воде. Жиры по химическому строению представляют собой соединение трёхатомного спирта – глицерина с остатками жирных кислот (рис. 156). Жирные кислоты могут быть ненасыщенными или насыщенными, в зависимости от того, имеют они в структуре своей молекулы двойную связь или нет. Соответственно, образованные ими жиры тоже делятся на ненасыщенные и насыщенные. Ненасыщенные жиры при комнатной температуре находятся в жидком состоянии. Из жиров, употребляемых человеком в пищу, к ним относятся растительные масла (подсолнечное, кукурузное, оливковое и др.). Насыщенные жиры при такой температуре находятся в твёрдом состоянии, в чём легко убедиться на примере сливочного масла и сала. Если через ненасыщенное растительное масло пропустить при определённых условиях водород, он присоединится по месту двойной связи в остатке жирной кислоты, и жир станет насыщенным. Подобным образом из растительного масла получают маргарин.
Чрезмерное употребление насыщенных жиров животного происхождения может привести к опасным последствиям. Дело в том, что они содержат холестерин – вещество, необходимое для жизни, но при избытке способное вызывать закупорку кровеносных сосудов. Это нередко приводит к инсультам и инфарктам. Поэтому животные жиры надо употреблять в ограниченном количестве, заменяя их по возможности растительными маслами.
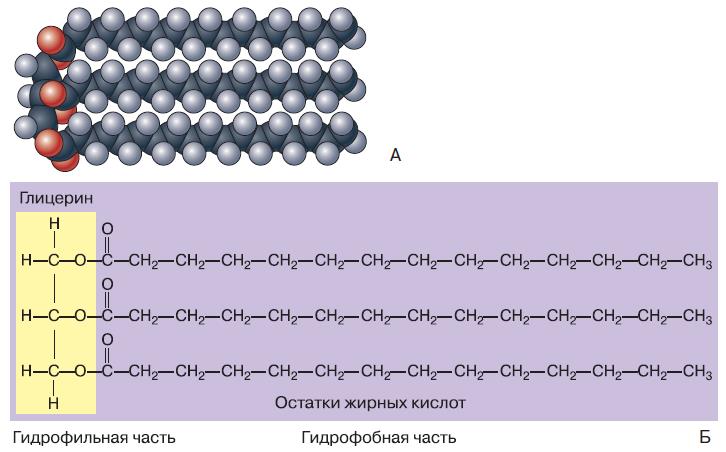
Рис. 156. Модель (А) и схема строения (Б) молекулы нейтрального жира
В организме жиры являются источником энергии и метаболической воды, участвуют в терморегуляции и выполняют защитную функцию. Не менее важное значение имеют жироподобные вещества. Представители этой группы – фосфолипиды – формируют основу всех клеточных мембран.
Проверьте свои знания
1. Приведите примеры известных вам белков. Какие функции они выполняют?
2. Как образуются вторичная и третичная структуры белка?
3. Вспомните из курса «Человек и его здоровье», какие аминокислоты называют заменимыми, а какие – незаменимыми? Что такое полноценные и неполноценные белки? В какой пище содержатся такие белки?
4. К насыщенным или ненасыщенным жирам относится вещество, изображённое на рисунке 156? Объясните свою точку зрения.
5. A, D, E и K, обладающие высокой биологической активностью. Вспомните из курса «Человек и его здоровье» функции этих витаминов и симптомы их недостаточности. К жироподобным веществам относят также жирорастворимые витамины
6. Объясните, почему липиды не относят к биополимерам.
Задания
1. Подберите эпиграф к данному параграфу.
2. Выясните, что произойдёт с белком яйца, если на него подействовать водой, спиртом, ацетоном, кислотой, растительным маслом, высокой температурой и т. д. Удастся ли восстановить структуру белка, вернувшись к исходным условиям?
3. Используя дополнительную литературу и ресурсы сети Интернет, выясните, почему холестерин называют веществом, необходимым для жизни. Выясните, какой у вас уровень холестерина. Оцените, насколько он соответствует норме. Сделайте выводы о своём рационе питания.
Ваша будущая профессия
1. Смоделируйте ситуации, в которых вам могут пригодиться знания, полученные при изучении данной главы.
2. Какие профессии может выбрать специалист в области химии?
3. Согласно официальной статистике, за период с 1999 по 2004 г. Россию покинули 25 тыс. учёных, а 20 тыс. ежегодно работают по системе контрактов за рубежом, что составляет примерно 5–6 % от общего научного потенциала страны. По мнению многих современных социологов, Россия только набирает силу по числу уехавших специалистов. Обсудите в классе, каковы, на ваш взгляд, причины «утечки мозгов». Что можно сделать, чтобы молодые специалисты оставались работать на Родине? (Круглый стол.)
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОК