§ 39 Открытие радиоактивности и модель атома Резерфорда
Модель атома, предложенная Томсоном, просуществовала почти десять лет. Но за это время накопились новые научные факты, которые эта модель объяснить не могла, например радиоактивность. Первооткрывателем этого явления можно считать французского физика Антуана Анри Беккереля (1852–1908). В 1896 г. ему удалось случайно обнаружить, что соли урана обладают свойством засвечивать в полной темноте фотографическую пластинку. Так как интенсивность почернения пластинки не зависела от того, какая именно соль урана использовалась, Беккерель пришёл к выводу, что сам по себе металл, называемый ураном, испускает какое-то излучение. Первоначальное предположение, что это излучение является рентгеновским, не подтвердилось. Стало ясно, что уран испускает излучение, до тех пор неизвестное. Исследования Беккереля были продолжены супругами Пьером Кюри (1859–1906) и Марией Склодовской – Кюри (1867–1934) (рис. 101). Им удалось обнаружить ещё три химических элемента, испускающих невидимые лучи.

Рис. 101. Пьер и Мари Кюри в лаборатории

Рис. 102. Эрнест Резерфорд
Этими элементами оказались торий, радий и полоний. Излучение было названо радиоактивным, а само явление – радиоактивностью. Впоследствии оказалось, что радиоактивное излучение способны испускать многие элементы, имеющие большой атомный вес. У некоторых элементов, не обладающих радиоактивностью в обычных условиях, она возникает после того, как они сами были облучены радиоактивным излучением. Это явление получило название искусственной радиоактивности.
Природа радиоактивности стала главным предметом изучения английского физика новозеландского происхождения Эрнеста Резерфорда (1871–1937) (рис. 102), работавшего в той же лаборатории Кембриджского университета, что и Томсон. В 1899 г. ему удалось установить, что радиоактивное излучение состоит по крайней мере из двух составляющих, которые он назвал альфа- и бета-излучением. Оба эти вида излучения состояли из электрических зарядов, так как отклонялись под действием магнитного поля. Вскоре была обнаружена и третья составляющая радиоактивности, не имеющая электрического заряда, которую по аналогии назвали гамма-излучением. В дальнейшем удалось выяснить, что альфа-лучи являются потоком атомных ядер химического элемента, называемого гелием, бета-лучи – потоком электронов, т. е. катодными лучами, а гамма-лучи, как вы уже знаете, представляют собой электромагнитное излучение очень высокой частоты. Разделить суммарное радиоактивное излучение на эти три составляющие в эксперименте несложно. Для этого нужно пропустить пучок излучения через магнитное поле. Препарат радия помещают на дно узкого канала в куске свинца. Напротив канала находится фотопластинка. На выходящее из канала излучение действует сильное магнитное поле, под действием которого пучок распадается на три пучка (рис. 103). Два из них отклоняются в противоположные стороны, что указывает на наличие у этих излучений электрических зарядов противоположных знаков. При этом отрицательный компонент излучения (бета– лучи) отклоняется магнитным полем гораздо сильнее, чем положительный (альфа-лучи). Третья, нейтральная составляющая (гамма– лучи) не отклоняется магнитным полем.
Резерфорд провёл эксперимент, в котором из радиоактивного излучения выделяли пучок положительно заряженных (лишённых электронов) атомов гелия, называемых альфа-частицами.
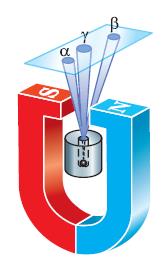
Рис. 103. Расщепление радиоактивного излучения в магнитном поле
Эти частицы ударялись о тонкую металлическую фольгу и после взаимодействия с её атомами рассеивались, т. е. разлетались в соответствии с законами столкновения. Рассеянные частицы попадали на экран, покрытый веществом, способным светиться под ударами быстрых заряженных частиц. Резерфорд обнаружил, что большинство альфа-частиц пролетает через слой металла, практически не подвергаясь какому-либо отклонению. Некоторые частицы отклонялись на небольшие углы, и только одна из десяти тысяч отскакивала назад под углом, близким к 180°.
Этот результат находился в резком противоречии с моделью атома Томсона. Если бы атом представлял собой плотную массу, вероятность того, что частица отскочит от него назад под большим углом, была бы значительно больше. Размышляя над причиной неожиданного результата эксперимента, Резерфорд пришёл к выводу, что атом на самом деле почти пустой, а весь его положительный заряд сосредоточен в объёме, очень малом по сравнению с величиной всего атома. Эту небольшую часть атома Резерфорд назвал атомным ядром.
Предложенную Резерфордом модель строения атома называют планетарной. Согласно ей в центре каждого атома находится небольшое положительно заряженное ядро, а вокруг него на огромных по сравнению с размерами ядра расстояниях находятся отрицательно заряженные электроны. Эти электроны вращаются по определённым траекториям вокруг ядра подобно тому, как планеты движутся по орбитам вокруг Солнца. Результаты экспериментов Резерфорда можно объяснить тем, что подавляющее большинство альфа-частиц, бомбардирующих атом, практически свободно проникают через его электронную оболочку, не испытывая существенного отклонения из-за того, что их масса значительно больше массы электрона. Частицы, пролетающие в непосредственной близости от ядра, отклоняются в сторону из– за отталкивания их заряда от положительно заряженного ядра. В исключительных случаях частицы сталкиваются непосредственно с ядром и отскакивают назад, но из-за малых размеров ядра такое случается крайне редко. Подобное объяснение строения атома было предложено ещё в 1903 г. японским физиком Хантаро Нагаоко, но она не получила признания из-за отсутствия в то время подтверждающих её экспериментальных данных.
Проведённые Резерфордом вычисления показали, что атомное ядро имеет радиус менее 10-12 см, так что размер всего атома, составляющий около 10-8 см, определяется величиной его электронной оболочки. Таким образом, размер электронной оболочки атома в десятки тысяч раз превышает размер его ядра. В то же время 99,98 % массы атома сосредоточено именно в ядре.
Исследование радиоактивности позволило убедиться в том, что ядра обладающих этим свойством химических элементов способны распадаться, выбрасывая частицы, которые по размеру значительно меньше их самих. Это показывало, что не только атом, но и его ядро делимы. Вопрос был в том, справедливо ли это для всех химических элементов или только для тех, которые обладают радиоактивными свойствами. Для того чтобы это проверить, Резерфорд стал бомбардировать не обладающий радиоактивностью азот альфа-частицами. При этом он наблюдал появление однократно ионизированных атомов водорода. На основании полученных результатов Резерфорд заявил, что
«создаётся впечатление, что атомы водорода рождаются в результате расщепления ядра азота».
Было общепризнано, что ядра всех атомов содержат протоны независимо от того, происходит ли в них спонтанный радиоактивный распад или нет. Таким образом, стало возможным приблизиться к пониманию строения атома и его ядра.
Планетарная модель Резерфорда приобрела широкую популярность. Помимо того что она удовлетворительно объясняла строение атома, её стали пропагандировать «космисты», стремившиеся единообразно объяснить все природные явления. Идея многократно эксплуатировалась писателями-фантастами и просто склонными к философии людьми, предполагавшими, что атомы являются полной аналогией планетарной системы, а на электронах, возможно, существует разумная жизнь. Напротив, наши планетарные системы являются, в свою очередь, атомами какого-то гигантского сверхвещества.
На самом деле модель Резерфорда, хотя и была признана научным сообществом, имела недостатки, порождавшие многочисленные вопросы. Если ядро атома состоит из протонов, то откуда при радиоактивном распаде возникает бета-излучение, представляющее собой, как известно, поток электронов? Почему заряд атомного ядра равен сумме зарядов составляющих его протонов, а его масса вдвое превышает сумму масс этих протонов? Модель Резерфорда противоречила законам электродинамики, согласно которым электрон при вращательном движении должен излучать электромагнитные волны, а следовательно, терять энергию. Расчёты показывали, что по этой причине электрон через самое короткое время должен упасть на ядро. Усовершенствовать модель, разрешив имеющиеся противоречия, удалось Нильсу Бору. Но для этого пришлось создать новую науку, которую назвали квантовой физикой или квантовой механикой.
Проверьте свои знания
1. Кто и в каких экспериментах открыл явление радиоактивности?
2. Что представляют собой альфа-, бета– и гамма-лучи? Каким образом можно их разделить?
3. Как называется модель атома, предложенная Э. Резерфордом? Почему она так называется?
4. Каково примерное соотношение между размером атома и размером его ядра?
5. Какие явления не могли быть объяснены с помощью модели атома Резерфорда?
Задания
1. Подберите эпиграф к данному параграфу.
2. Схематично изобразите планетарную модель Резерфорда.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОК